Microscopie et champignons
La détermination des champignons n'est pas toujours chose facile.
Pour l’amateur, devant la multitude d'espèces existantes, il est presque impossible d'identifier avec sûreté un champignon par la seule image couleur rencontrée dans un atlas ou sur un site
internet.
La première démarche, incontournable, consiste à se familiariser avec les principaux genres et groupes de champignons. S’agit-il d’un Tricholome,
d’un Clitocybe, d’un Hygrophore…etc ?
Pour ce faire, des clés simplifiées basées sur des caractéristiques morphologiques appréciables par tous, existent dans la plupart des ouvrages de vulgarisation.
Elles sont très faciles à utiliser et largement illustrées de photos pédagogiques dans la clé USB : Identifiez les champignons 2.0.
Cette étape franchie, vient alors le moment de déterminer l’espèce...
Si certaines, parmi les plus courantes et populaires ne présentent pas de grosses difficultés, d’autres, au contraire, demandent que l’on s’y attarde un peu plus.
Mais pour ceux qui souhaitent approfondir leurs connaissances mycologiques, les limites de l’observation macroscopique seront bientôt atteintes et il sera alors temps d’explorer l’infiniment petit…
Pour aller à l’encontre d’une idée reçue, l’utilisation d’un microscope n’est pas forcément réservée à une certaine élite. Pour autant, avant de réaliser une première préparation, une prise en mains de l’appareil est nécessaire.
Ceux qui n'ont pas eu la chance d'utiliser ce type de matériel en milieu scolaire, essaieront de se rapprocher d'une association mycologique ou de se documenter sur
internet, par exemple...
Que faut-il observer avec le microscope ?
Si l’apprenti mycologue se limite dans un premier temps à l’observation des spores* et des cystides*, il obtiendra de bons résultats sans trop de difficultés. Il pourra ainsi contrôler sa détermination macroscopique préalable ou encore suivre une clé de détermination utilisant des données plus « scientifiques ». Dans un deuxième temps, lorsqu’il se sentira plus à l’aise avec les préparations, il pourra explorer la cuticule ou encore s’intéresser aux pigments…
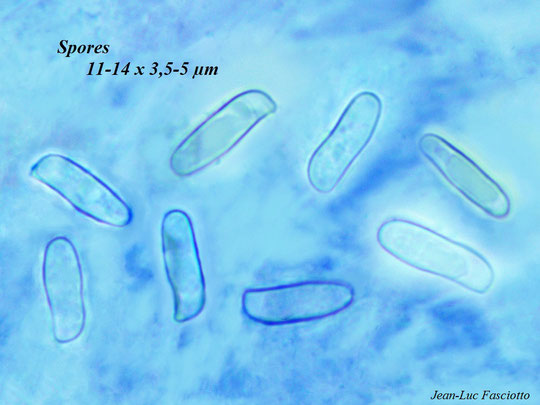
* Les spores (éléments unicellulaires microscopiques disséminés par le champignon pour en assurer la multiplication).
Elles sont faciles à obtenir… sur un petit fragment d’hyménium ou encore mieux, sur une sporée.
On peut observer leurs couleurs, leurs formes, leurs ornementations mais aussi les mesurer avec un oculaire gradué. Ces informations obtenues peuvent être comparées avec les indications des ouvrages de mycologie.
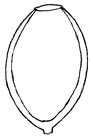
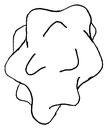
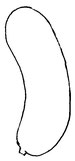
Quelques exemples :




* Les cystides (organes stériles de formes et de dimensions variables se trouvant dans l'hyménium des basidiomycètes).
Ces éléments sont également faciles à observer lorsqu’ils sont présents dans le champignon (certaines espèces n’en possèdent pas). Leurs formes et leurs dimensions sont très variables. Ici, la difficulté est de trouver la littérature adéquate pour pouvoir comparer les données.
Quelques exemples :





Diverticulées
Quelques photos au microscope...
Voici quelques exemples d'espèces macroscopiquement ressemblantes et pour lesquelles une vérification au microscope s'avère utile :
- Giromitra gigas et Gyromitra esculenta
- Strobilurus esculentus, Strobilurus tenacellus et Strobilurus
stephanocystis
- Tuber melanosporum et Tuber indicum
Photos diverses...
(classées par ordre alphabétique des genres)
Agrocybe elatella ; spores, cheilocystides et piléocystides.
Badhamia panicea ; classe des Myxomycètes. Spores claires, rondes et finement ponctuées... avec granules calcaires et capillitium.

Clitocybe phaeophthalma ; hyphes de la cuticule nettement ampulacées, caractéristique de cette espèce.

Coprinus sterquilinus ; grandes spores elliptiques 17-24 x 11-14 µm, montrant un pore germinatif net, central ou un peu excentré.
Cylindrobasidium evolvens ; spores en forme de larme ou de pépin, leptocystides fusiformes.

Mycena galericulata ; spores et cheilocystides clavées, ornées de diverticules et d'excroissances digitées.

Myxarium nucleatum ; spores +/- allantoïdes, parfois déformées. Hypobasides globuleuses, prolongées par 2 ou 4 épibasides vermiformes.

Pachykytospora tuberculosa ; spores verruqueuses à parois épaisses. Les verrues semblent souvent +/- disposées longitudinalement.

Panaeolina foenisecii ; spores 12-16 x 7-10 µm, nettement verruqueuses et à pore germinatif +/- proéminent.

Parasola auricoma ; présence de poils brun jaune caractéristiques sur la cuticule du chapeau (entre 100 et 300 µm de longueur).

Perrotia flammea ; spores oblongues, hyalines, droites ou le plus souvent courbées, montrant 1 cloison centrale à maturité.

Psathyrella bipellis ; spores avec pore germinatif net et cystides fusiformes, lagéniformes ou utriformes.

Psathyrella clivensis ; spores à pore germinatif absent ou peu visible et cystides fusiformes ou lagéniformes.

Psathyrella pigmaea ; spores avec pore germinatif et cystides utriformes souvent couronnées de cristaux.
Russula fuscorubroides ; spores.

Scutellinia trechispora ; spores sphériques, ornées de grosses verrues +/- coniques et tronquées au sommet.